Prof. Dr. habil Kovács Levente, Dr. Eigner György, Dr. Drexler Dániel András
A kutatás fő irányai
- A tumor növekedési modelljének azonosítása
- Kvázi folyamatos, alacsony dózisú terápia
- Optimális robusztus vezérlő algoritmusok
- Személyre szabott kezelés
A kutatás részletes leírása
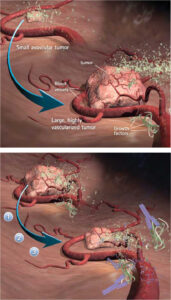
A rák napjainkban az egyik legpusztítóbb betegség, amely a legtöbb esetben halálos. A legfrissebb statisztikák szerint az Európai Unió becslése szerint 2011-ben 1,3 millió ember hal meg rákban [1]. Sajnos Magyarország az Európai Unió vezető országa (és a világ első tíz helyezettje is) a rák minden típusának halálozási adataiban [2], [3]. A hagyományos citotoxikus kemoterápia célja közvetlenül a tumorsejtek elleni küzdelem; hatással van azonban a beteg bizonyos egészséges sejtjeire is. Ezenkívül a daganatsejtek rezisztenssé válhatnak a kemoterápiában alkalmazott gyógyszerekkel szemben, ami szükségessé teszi az új gyógyszerek alkalmazását. A hagyományos kezeléstől eltérően az antiangiogén terápiának korlátozott mellékhatásai vannak, és a tumorsejtek nem tudnak rezisztenssé válni az angiogén gyógyszerekkel szemben. Ezt úgy érjük el, hogy a tumorsejtek helyett az endothel sejteket célozzuk meg. A daganatok kontrollálatlanul nőnek; kritikus térfogat felett azonban nem tudnak elegendő tápanyaghoz jutni az interstitiumból, ezért érrendszerre van szükségük ahhoz, hogy ezt az angiogenezis stimulálásával elérjék [4]. Az antiangiogén terápia célja az angiogenezis gátlása, de a magas költségű endosztatin gyógyszer alkalmazása többnyire klinikai szakértelemen alapul. Következésképpen az volt a célunk, hogy kombináljuk a kontrollelmélet előnyeit az antiangiogén terápiával a kezelés optimalizálása érdekében.
A Harvard Medical School bemutatta a tumor növekedésének angiogén gátlás alatt álló modelljét, amelyet tüdőrákos egereken végzett kísérletek segítségével validáltak [5]. Az egyszerűsített modellt [6] mutatta be, feltételezve, hogy a tumor térfogata és az endothel térfogata együtt mozog. A modellre vonatkozó elméleti vizsgálataink bebizonyították, hogy a beadott inhibitor koncentrációt egyszerű differenciálegyenlettel feltételezhetjük [7]. Ily módon a Dirac delta típusú arányokat, ami azt jelenti, hogy a gyógyszert injekció formájában kapták a betegnek, az infúziós kezelésnek megfelelő lépésfüggvény-bemeneti típusok változtatták meg. Ezeket a feltételezéseket az egyensúlyi állapot és a dinamikus elemzés szimbolikus számításai bizonyították [8].
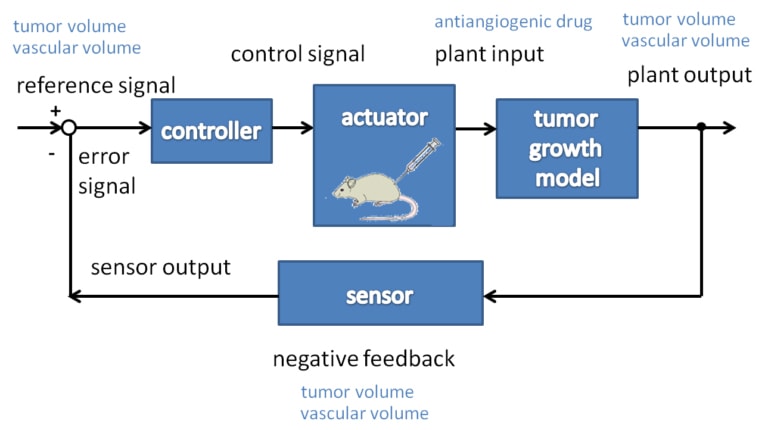
Miután megvizsgálta a nemlineáris modell munkapont-linearizálását a lineáris vezérlési jellemzőkkel (megfigyelhetőség és irányíthatóság) együtt, a figyelembe vett modellre egy lineáris kvadratikus (LQ) vezérlőt és egy pólus elhelyezésen alapuló megfigyelőt terveztek [9].
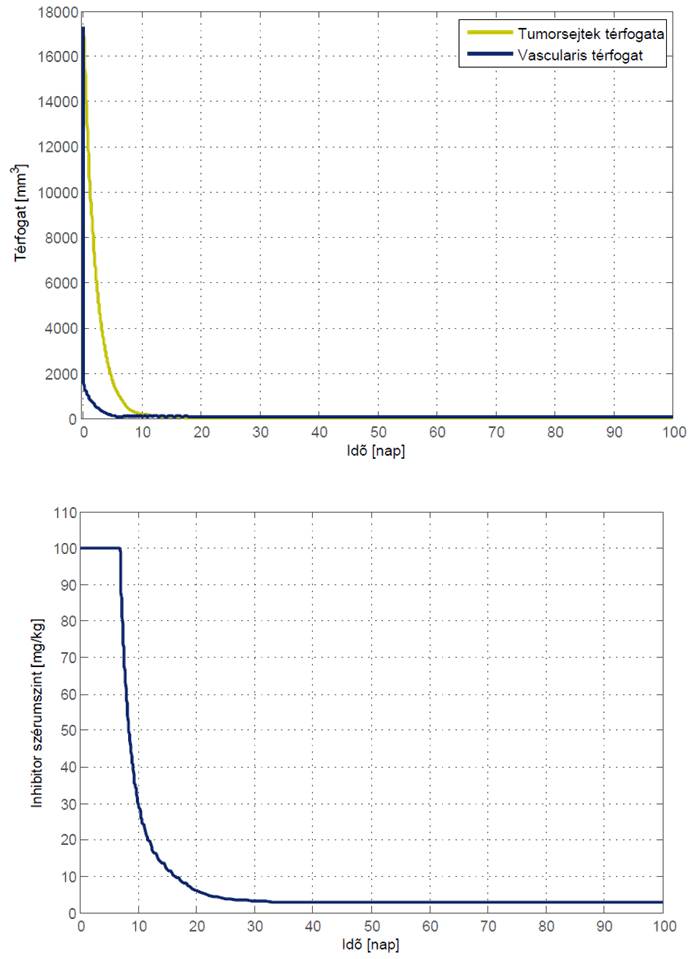
A szimulációs eredmények azt mutatták, hogy az egyszerű optimális terápia hasznos lehet. Első eredményeink azt mutatják, hogy az optimális terápia egy intenzív periódussal kezdődhet, ahol a daganat térfogata összenyomódik, majd egy fenntartó periódus következik, ahol az inhibitor minimális értékét megadják a betegnek.
A vezérlő fő jelentősége a kapcsolási idő kiosztásában van, amikor az intenzív periódust le kell állítani, és meg kell kezdeni a fenntartási periódust.
A további vizsgálatok más kontroll stratégiák (nemlineáris kontroll, modern robusztus kontroll) egyéb alkalmazására, valamint egérkísérleteken alapuló modellazonosításra, modellellenőrzésre és biostatisztikus értékelésre összpontosulnak a klinikai szakértőkkel együttműködve.
[1] Malvezzi M., Arfé A., Bertuccio P., Levi F., La Vecchia C., Negri E .: Európai rákos halálozási előrejelzések a 2011. évre, Annals of Oncology , 2011, doi: 10.1093 / annonc / mdq774.
[2] WHO, a Rákkutatás Nemzetközi Ügynöksége, http: / /www-dep.iarc.fr/ .
[3] WHO, Globális Egészségügyi Megfigyelő Intézet, http://www.who.int/gho/en/ .
[4] A. Hoeben, B. Landuyt, M. Highley, H. Wildiers, AT Van Oosterom, EA De Bruijn , Vascularis endothelialis növekedési faktor és angiogenezis, Pharmacol Rev. , vol. 56, 549–580., 2004.
[5] Hahnfeldt P., Panigrahy D., Folkman J., Hlatky L .: Tumorfejlődés angiogén jelátvitel alatt: A tumor növekedésének, a kezelési válasznak és a posztvascularisnak dinamikus elmélete nyugalom, Cancer Research , 1999, Vol. 59, 4770-4775. P.
[6] Ledzewitz U., Schatler H .: Optimális kontrollok szintézise a daganat növekedésének modelljéhez angiogén inhibitorok alatt, Proc. a 44. IEEE Konferencia a döntésről és az ellenőrzésről, valamint az Európai Ellenőrzési Konferencia , Sevilla, Spanyolország, 2005, 934-939. oldal.
[7] Drexler DA, Harmati I., Kovács L. : A tumor növekedésének optimális szabályozása antiangiogén kemoterápiával, Proc. 3. Int. Konf. A mechatronika, az automatizálás, az informatika és a robotika legújabb eredményeiről , Targu-Mures, Románia, 2011, 273-284. Oldal.
[8] Drexler DA, Kovács L., Sápi J., Harmati I., Benyó Z .: Daganatnövekedés modellalapú elemzése és szintézise angiogén gátlás alatt: esettanulmány, in Proc. of Automatikus vezérlés Nemzetközi Szövetségének 18. Világkongresszusa , Milano, Olaszország, 2011, 3753-3758. o. [9] Sápi J., Drexler DA, Harmati I., Sápi Z ., Kovács L., A tumor növekedésének kontrolljának lineáris állapot-visszacsatoló kontroll szintézise antiangiogén terápiában., In: SAMI 2012 – 10. Nemzetközi Szimpózium az alkalmazott gépi intelligenciáról és informatikáról . Herlany, Szlovákia, 2012, 143-148.